Разработка инновационных противоопухолевых препаратов на основе таргетных пептидных конструкций.
Разработан уникальный подход создания новых противоопухолевых препаратов, основанный на использовании инновационной технологии внутриклеточной доставки высокомолекулярных соединений с помощью СРР (cell penetrating peptides, интернализуемых пептидов). В рамках данной технологии исследован спектр химерных пептидных конструкций, включающих в составе одной полипептидной цепи транспортные последовательности и функциональные последовательности ингибирующие ключевые мишени канцерогенеза (в т.ч. циклиновые киназы). Полученные результаты показали перспективность использования данной технологии для получения антипролиферативных лекарственных средств, имеющих широкий спектр противоопухолевой активности.
Разработанные с применением инновационной технологии противоопухолевые препараты обладают следующими свойствами:
эффективная доставка в опухолевые ткани за счет использования технологии интернализуемых пептидов;
высокая противоопухолевая активность (рак желудка, немелкоклеточный рак легкого, колоректальный рак, и др.);
низкая неспецифическая токсичность.

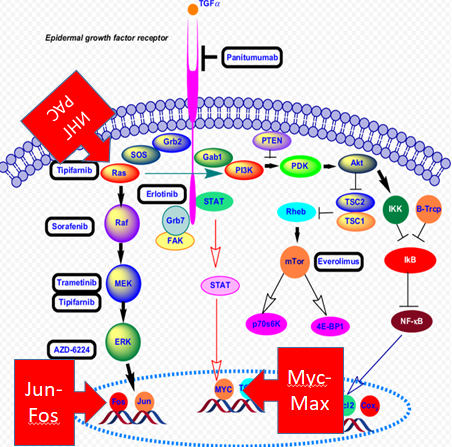
Разрабатываемые пептидные ингибиторы для противоопухолевой терапии направлены на важные молекулярные мишени, ключевые точки клеточного деления, для которых в настоящее время отсутствуют эффективные ингибиторы.
Ингибитор Ras-ГТФазы (Инг-Рас, К26К) находится на I-IIa стадии клинических испытаний; ингибитор CDK4/6 (MMD37-K) завершена I фаза при внутривенном введении препарата и ведутся работы по подготовке ко II фазе клинических испытаний; проводятся доклинические исследования пептидных ингибиторов Jun-Fos, Myc-Max, E2F-DP2 ингибиторы CDK2.

Разработка CAR-T и TCR-T технологий для лечения солидных опухолей.
Разработана собственная уникальная технология получения CAR-T продуктов. Использование в качестве генно-модифицирующих агентов векторной плазмиды, а не вирусных векторов, как средства доставки гена химерного рецептора, существенно удешевляет и ускоряет производство конечного продукта, а также обеспечивает полную безопасность, с точки зрения возможной генетической модификации и канцерогенности данного вида технологии. Весь цикл производства от момента забора клеточного материала до получения конечного продукта составляет 48-72 часа и может быть произведен «у постели пациента».
Исследования по воздействию радиационного излучения на биологические объекты.
На базе лаборатории ведутся проекты совместно с Федеральным государственным бюджетным учреждением науки «Объединенный институт высоких температур Российской академии наук» (ОИВТ РАН), Институт ядерных исследований Российской академии наук, Троицк. Проводятся исследования высокомощностной лучевой терапии, изучение радиобиологических особенностей и противоопухолевой эффективности фотонных пучков сверхвысокой мощности дозы (Ultra-high DR– U-hDR, мощность дозы 600 МГр/мин, разовые дозы 0,5-20Гр, подводимые в импульсном режиме 50-60 нс). Использованы экспериментальная установка «Ангара» (ТРИНИТИ) и наносекундный ускоритель электронов Мир-М (создан стенд для облучения экспериментальных животных), проведено сравнение эффектов со стандартным гамма-терапевтическим излучением Со-60. Ведутся исследования воздействия протонной флэш-терапии (Линейный ускоритель ИЯИ РАН) на клетки культур опухолевых линий и оценка возможности клинического применения данного метода.
Исследования по разработке новых молекулярно-генетических методов для ранней и дифференциальной диагностики, стадирования, а также мониторинга злокачественных новообразований ведутся по двум направлениям:
Исследование экспрессионных профилей генов в тканях опухолей и морфологически неизмененных тканях с целью создания методов диагностики и прогноза.
Разработаны следующие методы:
молекулярно-генетический метод дифференциальной диагностики патологии толстой кишки (КРР, полипы). Точность метода - 98%; чувствительность - 86,3%; специфичность- 100%; метод валидирован на выборке выключающей 926 образцов тканей от 519 пациентов. Подана заявка на патент;
метод прогноза рецидивирования рака молочной железы. Точность метода - 90%. Полностью реализуется на Российском оборудовании и реагентах. Ведется валидация метода в рамках клинической апробации МЗ РФ для включения в клин.рекомендации (список 2022 год, протокол № 2022-31-2). (Патент RU 2619739 C);
метод прогноза рецидивирования колоректального рака. Ведутся доклинические исследования;
методы прогноза рецидивирования неинвазивного рака мочевого пузыря и рака предстательной железы. Ведутся доклинические исследования и валидация методов.